You are here
Cosa sono gli studi clinici
Questo sito contiene informazioni comprensibili e affidabili sugli studi clinici. Clicca sulle domande qui sotto per risposte chiare e concise.
Perché gli studi clinici sono importanti?
Coloro che partecipano ad uno studio clinico, sia come pazienti che come volontari sani, contribuiscono all'avanzamento della medicina e ad un futuro migliore per i pazienti.
I farmaci esistenti possono risultare inadatti o inefficaci per molti pazienti. Questo è il motivo per cui centinaia di migliaia di scienziati in tutto il mondo stanno conducendo ricerche su nuovi farmaci e trattamenti. Tuttavia, questi farmaci non possono essere commercializzati senza prima condurre studi clinici con volontari e pazienti sani. Questi studi clinici sono condotti al fine di valutare l'efficacia, l'effetto e la sicurezza a lungo termine del farmaco. Inoltre, nuovi farmaci o trattamenti sono anche confrontati con quelli esistenti.
È necessario che un numero sufficiente di persone partecipi a questi studi in modo da poter trarre conclusioni scientificamente fondate.
Che cos'è la ricerca clinica?
Quando si sta sviluppando un nuovo farmaco, è necessario dimostrare che questo sia sicuro e funzioni prima che possa essere commercializzato.
Lo sviluppo dei farmaci è suddiviso in ricerca preclinica, condotta all'interno di provette e sugli animali, e ricerca clinica, condotta sulle persone. Solo dopo aver dimostrato che il nuovo prodotto è sicuro ed efficace negli esperimenti sugli animali, può essere studiato sulle persone.
I test che vengono condotti sulle persone per scoprire se il nuovo prodotto è sicuro ed efficace sono chiamati studi clinici. Questi studi sono condotti in quattro fasi consecutive (I, II, III e IV). L'obiettivo di uno studio clinico dipende dal nuovo prodotto che si sta studiando.
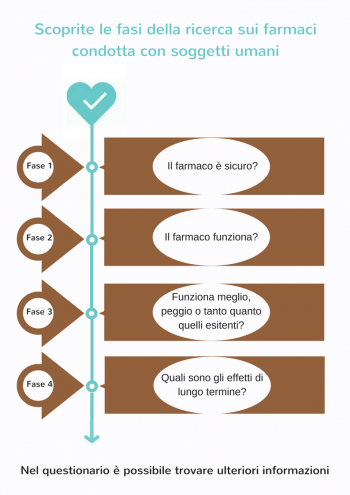
Quali sono le fasi della ricerca clinica nelle persone?
-
Ricerca preclinica all'interno di provette e sugli animali
-
Ricerca clinica sulle persone
La ricerca clinica è costituita da studi clinici rigorosamente controllati in 4 fasi consecutive.
-
Studi di fase 1 – il farmaco è sicuro?
Il nuovo farmaco potenziale viene solitamente somministrato a un piccolo gruppo (da 20 a 100) di volontari sani per studiare gli effetti generali (distribuzione, metabolismo ed eliminazione, nonché eventuali effetti collaterali) del nuovo farmaco.
- Studi di fase 2 – il farmaco funziona?
Se i risultati dello studio di fase I mostrano che il potenziale nuovo farmaco è sicuro, uno studio di fase II viene avviato su un piccolo gruppo di pazienti selezionati (da 100 a 500) che vi prendono parte volontariamente. Durante questa fase, i ricercatori indagano se il nuovo farmaco funziona per la malattia per la quale è stato sviluppato. I pazienti che possono partecipare sono selezionati in base a criteri di inclusione ed esclusione rigorosi. Questo viene fatto al fine di ridurre al minimo la variazione all'interno del gruppo in modo da poter trarre conclusioni scientificamente fondate.
- Studi di fase 3 – il farmaco funziona meglio, altrettanto bene o meno bene di farmaci o trattamenti esistenti?
Il potenziale nuovo farmaco viene studiato in un più ampio gruppo di pazienti (da 1.000 a 5.000) per studiarne l'efficacia e la sicurezza a lungo termine. In questa fase il farmaco viene confrontato con farmaci o trattamenti esistenti. Se è dimostrato che il farmaco produce risultati sufficienti o migliori ed è sicuro, riceve ufficialmente l'autorizzazione all'immissione in commercio. Da quel momento in poi, il nuovo farmaco è disponibile sul mercato e può essere prescritto dai medici.
-
Studi di fase 4 – quali sono gli effetti a lungo termine?
La sicurezza del nuovo farmaco continua ad essere monitorata anche dopo che è stato immesso sul mercato. Durante gli studi di fase IV, i ricercatori esaminano principalmente i possibili effetti collaterali che si verificano sporadicamente e con complicanze a lungo termine. Inoltre, i ricercatori a volte indagano se il farmaco è efficace per altre malattie o disturbi.
Chi conduce gli studi clinici?
Esiste una differenziazione tra (i) studi commerciali e (ii) studi non commerciali o accademici. L'iniziatore di uno studio commerciale è una società farmaceutica o una società che produce dispositivi medici. In uno studio accademico, l'iniziatore è un ricercatore di un ospedale.
Entrambi i tipi di studi devono seguire le stesse norme rigorose. Pertanto, in entrambi i casi un soggetto di studio è ugualmente ben protetto e ha gli stessi diritti e gli stessi obblighi.
Negli studi commerciali non c'è contatto diretto tra i pazienti e l'iniziatore. Ogni contatto passa attraverso un centro di studio partecipante e un ricercatore che è collegato allo studio. Il ricercatore assicura che i soggetti siano sorvegliati, seguiti ed esaminati.
Chi può partecipare ad uno studio clinico?
Sia i volontari sani che i pazienti possono essere coinvolti in uno studio.
Ogni studio ha condizioni specifiche, e queste sono sempre descritte nel protocollo di studio. Il protocollo di uno studio clinico include tutte le regole e le procedure dello studio. Questo è il libro di riferimento per la corretta conduzione di uno studio. Il protocollo deve essere sempre approvato da un comitato di etica medica e dalle rispettive autorità governative prima che lo studio possa iniziare.
Le condizioni di partecipazione sono denominate anche criteri di inclusione ed esclusione.
Possibili partecipanti:
- devono soddisfare le condizioni specifiche dello studio;
- sono e devono essere informati in modo esaustivo in base al modulo informativo;
- devono comprendere che cosa comporta la partecipazione, compresi i possibili rischi e benefici;
- devono poter partecipare in modo completamente volontario, come spiegato nel modulo informativo;
- devono essere assicurati contro eventuali danni;
- devono poter interrompere la partecipazione allo studio in qualsiasi momento;
- devono dare il proprio consenso e firmare un documento, noto come modulo d'informazione paziente e di consenso informato, all'inizio della procedura di studio.
Partecipare a uno studio clinico è sicuro? Chi garantisce questa sicurezza?
Gli studi clinici sono rigidamente regolamentati al fine di ridurre al minimo il rischio per i soggetti partecipanti. Al fine di proteggere i diritti, l'integrità e la riservatezza dei soggetti dello studio e la credibilità dei dati dello studio, le condizioni etiche e scientifiche internazionali sono specificate nella Dichiarazione di Helsinki e nelle Linea Guida per la Buona Pratica Clinica.
Prima di poter avviare uno studio clinico, è necessario ottenere l'approvazione da un comitato etico medico riconosciuto e dal governo (in Belgio si tratta dell'Agenzia Federale per i Medicinali e i Prodotti Sanitari). Entrambe le entità sopra citate forniscono raccomandazioni e valutano se il nuovo farmaco è sicuro e se i benefici del nuovo farmaco superano i potenziali rischi associati allo studio. È solo dopo aver ricevuto un parere favorevole (= approvazione) che lo studio può essere avviato.
Il comitato di etica medica competente controlla gli interessi dei partecipanti per l'intera durata dello studio. Lo studio può essere interrotto in qualsiasi momento, per esempio a causa di effetti collaterali intollerabili.
Quali sono i possibili rischi nel partecipare ad uno studio clinico?
In primo luogo un protocollo di studio è redatto per condurre uno studio clinico. Il protocollo di uno studio clinico include tutte le regole dello studio. Questo è il libro di riferimento per la corretta conduzione di uno studio. Il protocollo deve essere sempre approvato da un comitato di etica medica e dalle rispettive autorità governative prima che lo studio possa iniziare. Il comitato di etica medica controlla gli interessi dei partecipanti durante lo studio.
Nonostante questo, ci possono essere rischi o svantaggi associati alla partecipazione a uno studio clinico. Il profilo di rischio di uno studio è analizzato da varie parti (la società che sponsorizza lo studio, i medici, i comitati etici e il governo), e lo studio può essere avviato solo se i benefici superano i possibili rischi.
I rischi/svantaggi possono includere quanto segue:
- Il farmaco o trattamento è di solito nuovo ed è ancora in fase di studio. Ciò significa che molto spesso non tutti gli effetti collaterali del farmaco sono noti. Il rischio di effetti collaterali sconosciuti è diverso per ogni studio e non può essere sempre interamente previsto. Ecco perché il ricercatore fornisce le informazioni su questo argomento in anticipo. Naturalmente, tutti gli effetti collaterali sono attentamente monitorati sia dal ricercatore che dai comitati etici che vigilano sulla sicurezza di tutti i partecipanti. Inoltre, un partecipante può decidere di smettere di partecipare allo studio in qualsiasi momento.
- È possibile che il nuovo farmaco non abbia alcun valore aggiunto.
- Negli studi clinici di fase II e di fase III, il partecipante di solito non sa se sta ricevendo il farmaco o meno. Se è etico, il protocollo di studio può specificare un gruppo di controllo che non riceverà il prodotto attivo ma un placebo.
- La partecipazione può richiedere uno sforzo in più da parte del soggetto di studio che può includere ad esempio visite ospedaliere aggiuntive, esami o procedure (come il prelievo di campioni di sangue).
Domande sulla tua eventuale partecipazione
Stai pensando di partecipare ad uno studio clinico? Fai clic sulle domande seguenti per saperne di più sulla tua possibile partecipazione.
Perché partecipare ad uno studio clinico e quali sono i possibili benefici della partecipazione?
- Partecipando ad uno studio clinico sostieni la ricerca medica, contribuendo così al progresso della scienza medica.
- Partecipando come paziente si può beneficiare della più recente assistenza sanitaria, nonché di un possibile nuovo trattamento per la propria malattia la cui efficacia e sicurezza sono oggetto di indagine.
- I risultati degli studi possono inoltre aiutare i pazienti futuri sviluppando un nuovo potenziale farmaco, un nuovo vaccino, un test diagnostico migliore, ecc.
- Il ricercatore può eseguire più test di quelli che farebbe normalmente per monitorare gli effetti del farmaco somministrato il più attentamente possibile. Non ti verrà addebitato alcun costo per questi trattamenti e/o test aggiuntivi durante lo studio.
- Gli studi sono strettamente confidenziali e la tua privacy non sarà compromessa in nessun momento
Non vi è, tuttavia, alcuna garanzia che trarrai benefici personali dalla partecipazione. È inoltre necessario tener conto degli sforzi e dei rischi aggiuntivi che potrebbero essere associati a uno studio. I possibili benefici, ma anche gli svantaggi e i possibili rischi di uno studio specifico, saranno sempre spiegati e discussi con te in anticipo dal ricercatore.
Chi decide se puoi partecipare a uno studio clinico?
Il ricercatore valuta se ti è possibile partecipare ad uno studio clinico.
Partecipare ad uno studio clinico è sempre del tutto volontario. Se decidi di non prendere parte ad uno studio, questo non influenzerà in nessun caso il tuo ulteriore trattamento né influirà in nessun modo sul rapporto con il tuo medico curante. Inoltre, potete decidere di smettere di partecipare allo studio in qualsiasi momento.
Puoi trovare maggiori dettagli sul nostro ruolo nella nostra politica di riferimento.
Cosa succede con i tuoi dati durante uno studio clinico?
Se soddisfi i criteri di selezione e decidi di partecipare a uno studio clinico, la tua partecipazione e tutti i tuoi dati personali e medici saranno trattati in modo confidenziale in conformità con le leggi locali. Durante uno studio clinico i tuoi dati saranno criptati quando raccolti e trattati. Questi dati saranno elaborati e analizzati solo in un contesto scientifico correlato allo studio. Nelle successive pubblicazioni scientifiche dei risultati dello studio, non verranno condivise informazioni che potrebbero identificare personalmente i partecipanti allo studio.
In nessun momento il ricercatore condividerà con C-Lys i dati medici raccolti durante uno studio clinico. C-Lys è coinvolto solo nella preselezione di soggetti candidati.
Cosa succede se subisci danni durante uno studio?
Ogni studio clinico è accuratamente progettato in modo da mantenere il rischio al minimo. Tuttavia, non si possono escludere problemi imprevisti. Ecco perché la legge prevede che lo sponsor di uno studio sia obbligato a stipulare un'assicurazione per ogni studio clinico al fine di proteggere i partecipanti. C-Lys è coinvolto solo nella preselezione di soggetti candidati e non è responsabile per la tua partecipazione allo studio. Per ulteriori informazioni sull'assicurazione, puoi contattare il ricercatore dello studio.
Se sei interessato a prendere parte a uno studio clinico, un ricercatore può spiegarti in anticipo l'obiettivo dello studio e i possibili benefici. Il tuo medico ti farà inoltre notare che tali benefici non possono essere garantiti. Gli effetti collaterali possono sempre verificarsi a causa della fase di ricerca in cui si trova attualmente il farmaco o il trattamento.
Riceverai un compenso finanziario per la partecipazione a uno studio clinico?
I volontari sani che partecipano agli studi di fase I ricevono solitamente un compenso finanziario calcolato in base all'onere causato dai test (numero di campioni di sangue che devono essere prelevati, numero di ricoveri in ospedale, ecc.) a cui si è sottoposti per lo studio. Solitamente il compenso finanziario non è autorizzato legalmente per la partecipazione come pazienti agli studi di fase II, III e IV. In alcuni casi si può avere diritto al rimborso per il parcheggio e le spese di viaggio. In entrambi i casi il ricercatore dello studio sarà in grado di fornire maggiori informazioni al riguardo.
Il compenso finanziario o il rimborso delle spese saranno sempre pagati dallo sponsor dello studio. Poiché C-Lys è solo coinvolto nella preselezione di soggetti candidati, C-Lys non è responsabile per il pagamento di compensi ai soggetti in nessun caso.
Dove è necessario segnalare possibili effetti collaterali?
Quando si partecipa a uno studio clinico, è estremamente importante segnalare eventuali reazioni avverse o effetti collaterali al proprio medico curante. Questo aiuta a garantire la sicurezza del farmaco o trattamento.
Questo sito C-Lys non è destinato a segnalare possibili effetti collaterali. Per gli studi clinici, è applicabile una rigorosa regolamentazione per proteggere i partecipanti. A causa di questa situazione legale unica, i dipendenti di C-Lys non possono e non devono rispondere a domande relative a prodotti medici, trattamenti medici, effetti collaterali o studi clinici specifici. Abbiamo solo le informazioni che puoi trovare su questo sito. Le informazioni su studi specifici sono state preparate in consultazione con i ricercatori e approvate da un comitato etico competente.
Questo sito C-Lys non è destinato a condividere la vostra esperienza all'interno di uno studio clinico. Puoi essere tentato di parlare con altri che come te partecipano a un determinato studio clinico. Potresti iniziare a parlare dei possibili effetti collaterali o della tua esperienza, ma è importante non farlo. Dopo tutto, potrebbe influenzare l'esito dell'indagine. Esiste infatti il potere della suggestione; sentire di un effetto collaterale può essere sufficiente per ottenere realmente questo effetto collaterale.